Морфология рака простаты
Когда речь заходит о раке предстательной железы, перед врачом всегда встает две группы вопросов. Первая из них связана с необходимостью выявления гистогенетической принадлежности опухоли. Определение на светооптическом уровне гистогенетического варианта опухоли является первым шагом в выборе метода лечебного воздействия.
В процессе канцерогенеза в предстательной железе внутри совокупности эпителиоцитов развиваются очень сложные причинно - следственные взаимоотношения. С одной стороны, все группы простатических желез имеют в своем составе два гистогенетических типа клеток: клетки железистого эпителия в ацинарной части и клетки переходноклеточного (покровного) эпителия в дистальной части выводных протоков. Таким образом, изначально имеются предпосылки для развития двух гистогенетических групп опухолей - переходноклеточного рака и аденокарциномы. С другой стороны - в процессе неопластической трансформации эпителиоцитов, начиная от очаговой пролиферации, возможны метапластические изменения обеих гистогенетических групп клеток. При этом, переходноклеточный эпителий метаплазирует в железистый и плоский, а железистый - в плоский и переходноклеточный.
Эти переплетения направлений дифференцировки эпителиоцитов различных отделов предстательной железы, в свою очередь, создают предпосылки для развития трех гистогенетических групп рака предстательной железы, а именно - аденокарциномы, плоскоклеточного и переходноклеточного рака. В то же время, невзирая на указанные выше трансформации, эпителиоциты предстательной железы сохраняют признаки первоначальной гистогенетической принадлежности. То есть, клеточные элементы любой гистогенетической формы рака простаты, сохраняют тканетипические признаки исходной гистогенетической группы.
Вторая совокупность вопросов связана с оценкой степени злокачественности новообразования, что является основополагающим для выбора характера и интенсивности лечебного воздействия, в значительной степени определяет прогноз течения заболевания после лечения и, следовательно, особенности последующего диспансерного наблюдения больных. Таким образом, морфологическое исследование с максимально возможной точностью должно определить гистогенетическую принадлежность опухоли и степень дифференцировки составляющих ее клеточных элементов - базового показателя в определении степени злокачественности рака. Процесс канцерогенеза (озлокачествления) имеет строго очерченную стадийность.
При этом и мезенхимальные и эпителиальные опухоли проходят в своем развитии аналогичные стадии. Изменения начинаются с развития фокуса пролиферации клеточных элементов - т.е. увеличения их количества. Необходимо учитывать, что этот процесс в эпителии происходит постоянно в связи с физиологической регенерацией. В нормальных условиях, до тех пор, пока пролиферация ориентирована на замещение клеточных элементов погибающих в результате окончания их биологического цикла, она рассматривается как компенсаторно-приспособительный процесс, направленный на восполнение утраченного. Как только процесс выходит за эти рамки, его необходимо ассоциировать уже с патологическими состояниями, а именно - начальными стадиями онкогенеза. Компенсаторно-приспособительным процессом пролиферация может считаться только до тех пор, пока она направлена на восстановление структуры и проходит в рамках сохранения тканевой специфичности органа. Нарушение последней указывает на возникновение доброкачественного новообразования: в случае железистых структур - о развитии аденомы.
Теория онкогенеза, разработанная Л.М. Шабадом, доказывает возможность скачкообразного развития злокачественных новообразований (т.е. "перескакивания" через отдельные этапы). В соответствии с ней, нередко, процесс сразу может переходить к следующей стадии развития - диспластическим изменениям, минуя этап доброкачественного новообразования. Морфологическими критериями дисплазии являются изменения морфо-функциональных характеристик клеточных элементов, которые, однако, еще не достигают уровня клеточного атипизма. В зависимости от выраженности отличий морфологических и функциональных качеств клеточных элементов от нормальной клетки, характерной для данной эпителиальной выстилки, различают три степени дисплазии. При этом еще раз необходимо подчеркнуть, что признаков клеточного атипизма при различных стадиях дисплазии нет.
 Только при дисплазии 3 степени можно обнаружить незначительную гиперхромию ядер и некоторое смещение ядерно-цитоплазматических соотношений в сторону ядра. Однако, этих признаков недостаточно для того, чтобы расценивать их, как проявления клеточного атипизма. Дисплазия носит очаговый характер. В предстательной железе она поражает либо часть клеток, составляющих больший или меньший сектор ацинуса, реже весь ацинус и значительно реже - группу ацинусов. Дисплазия относится к обратимым процессам и никогда не выходит за рамки базальной мембраны эпителия. Обмен нуклеиновых кислот при дисплазии любой степени не превышает тетраплоидного содержания ДНК.
Только при дисплазии 3 степени можно обнаружить незначительную гиперхромию ядер и некоторое смещение ядерно-цитоплазматических соотношений в сторону ядра. Однако, этих признаков недостаточно для того, чтобы расценивать их, как проявления клеточного атипизма. Дисплазия носит очаговый характер. В предстательной железе она поражает либо часть клеток, составляющих больший или меньший сектор ацинуса, реже весь ацинус и значительно реже - группу ацинусов. Дисплазия относится к обратимым процессам и никогда не выходит за рамки базальной мембраны эпителия. Обмен нуклеиновых кислот при дисплазии любой степени не превышает тетраплоидного содержания ДНК.
Доминирующим путем энергетического обмена в паренхиматозных клетках при дисплазии любой степени является цикл обмена трикарбоновых кислот (Кребса) и терминальная цепь биологического окисления. Другими словами, все основные морфо-функциональные характеристики паренхиматозных клеточных элементов предстательной железы при дисплазии любой степени свидетельствуют о том, что они еще не перешли тот барьер, который отделяет их от клеток злокачественного новообразования. Как только клеточные элементы преодолевают эту границу, формируется морфологический феномен, носящий название "рака на месте", неинвазивного рака или карциномы in situ (CIS).
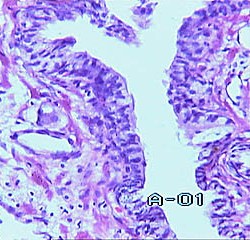 Неинвазивный рак отличается от инвазивного сохранностью базальной мембраны и очаговым поражением эпителиальной выстилки. Дискуссию, начатую еще в 60-е годы прошлого столетия Д.И. Головиным о возможности обратного развития CIS, до настоящего времени нельзя считать законченной. Нет никаких оснований полностью исключить возможность обратного развития "рака на месте".
Неинвазивный рак отличается от инвазивного сохранностью базальной мембраны и очаговым поражением эпителиальной выстилки. Дискуссию, начатую еще в 60-е годы прошлого столетия Д.И. Головиным о возможности обратного развития CIS, до настоящего времени нельзя считать законченной. Нет никаких оснований полностью исключить возможность обратного развития "рака на месте".
В настоящее время в мировой литературе усиленно внедряется понятие простатической интраэпителиальной неоплазии (PIN). Под этим понятием подразумевается совокупный комплекс морфологических изменений, характерных для дисплазии эпителия и карциномы in situ. При этом, дисплазия I, соответствует понятию PIN низкой степени (LPIN), а дисплазия II, III и CIS - понятию PIN высокой степени (HPIN).


Применение понятия интраэпителиальной неоплазии вполне допустимо, при условии обязательного указания степени дисплазии. В то же время, четкое разделение случаев дисплазии и карциномы in situ представляется нам более оправданным с позиций представлений об онкогенезе. Это связано с тем, что как было показано выше, по своей биологической природе дисплазия любой степени и CIS принципиально различны. Поэтому и лечебная тактика в отношении этих процессов также должна быть различной. Если дисплазия - это процесс, который отнесен к факультативному (необязательному) предраку, то CIS - это уже рак, но развивающийся в пределах базальной мембраны. В то же время, понятие HPIN отнесено к облигатному предраку за счет включения CIS. Диспластический процесс может развиться под воздействием онкогенного фактора и, в этом случае, должен расцениваться как патологический. В то же время, он может отражать ответ эпителия на стесненные условия существования, выступая, как истинный компенсаторно-приспособительный процесс. Важно отметить, что и в том и в другом случае, при исключении канцерогенного воздействия или устранении факторов, стесняющих условия существования эпителия, процесс дисплазии может самоликвидироваться.
Фактов, указывающих на возможность автономного существования эпителиоцитов в стадии дисплазии, их прогрессирующего размножения и инфильтрации окружающих тканей, другими словами свидетельствующих об агрессивном, характерном для злокачественных опухолей поведении, нет. Поэтому существует реальная возможность в этом случае применять выжидательную тактику с постоянным мониторингом больных у которых в ткани предстательной железы обнаруживается дисплазия любой степени. Наиболее оправданным представляется динамический контроль ПСА, при тенденции нарастания которого выполняется повторная биопсия простаты. Вопрос о возможности лечения / химиопрофилактики диспластических состояний (PIN) находится в стадии изучения. В отличии от этого больные с диагностированной CIS, нуждаются в более энергичных лечебных мероприятиях. Дальнейшее развитие процесса онкогенеза приводит к инвазивному раку - стадии, в которой разворачивается вся гамма морфологических изменений. Она имеет достаточно четко очерченные критерии морфологической диагностики. Наиболее частый вариант - это аденокарцинома, которая составляет 95,7% всех гистогенетических групп РПЖ. Ее морфологическим проявлением является наличие комплексов опухолевых клеток, формирующих железистоподобные структуры. Составляющие их клеточные элементы проявляют выраженные в большей или меньшей степени признаки анаплазии. Ядра различной формы и величины - гиперхромны, уродливы и содержат различное количество ядрышек. Их интерфазный хроматин располагается неравномерно, глыбками. Ядерно-цитоплазматические соотношения нарушены в сторону ядра. Указанные признаки злокачественности нарастают вместе со степенью анаплазии. Именно нарастание степени анаплазии клеточных элементов опухоли или, другими словами, степени выраженности клеточного атипизма, является основополагающим диагностическим критерием степени злокачественности опухоли.
Вместе с тем, любое злокачественное новообразование помимо клеточного атипизма обязательно проявляет признаки и тканевого атипизма. Железы различной формы и величины, формирующие опухоль, часто имеют уродливые очертания и не содержат выводных протоков. Выделяют множество вариантов аденокарциномы: ацинарную, трабекулярную, светлоклеточную, темноклеточную, слизистая и т.д., и т.д. Следует уберечь исследователей от попытки рассматривать эти варианты, как отдельные гистологические формы опухоли, так как по сути они представляют собой лишь характерные индивидуальные особенности роста аденокарциномы. Поэтому, данные показатели можно и нужно расценивать, как дополнительные по отношению к характеристике гистологической формы опухоли. Гистологическая же форма новообразования, содержит в себе синтетическую информацию, сочетающую, как мы уже сказали выше, гистогенетический тип и степени дифференцировки - сочетание характеристик клеточного и тканевого атипизма.
 Поэтому, аденокарциномы I степени дифференцировки представляют из себя новообразования, состоящие из атипичных клеток, формирующих хорошо определяемые железистые структуры. В этом случае клеточный атипизм не достигает значительной степени выраженности, а основной показатель злокачественного роста - плоидность клеточных элементов опухоли, а именно, концентрация анеуплоидных (не кратных 2) клеточных элементов, не достигает 2%. По мере увеличения степени анеуплоидии нарастают и проявления клеточного атипизма, происходят определенные изменения в морфологическом строении ткани опухоли - появляется солидный компонент.
Поэтому, аденокарциномы I степени дифференцировки представляют из себя новообразования, состоящие из атипичных клеток, формирующих хорошо определяемые железистые структуры. В этом случае клеточный атипизм не достигает значительной степени выраженности, а основной показатель злокачественного роста - плоидность клеточных элементов опухоли, а именно, концентрация анеуплоидных (не кратных 2) клеточных элементов, не достигает 2%. По мере увеличения степени анеуплоидии нарастают и проявления клеточного атипизма, происходят определенные изменения в морфологическом строении ткани опухоли - появляется солидный компонент.
Нарастание выраженности признаков клеточного атипизма и появление солидного компонента показывают, что опухоль снизила степень дифференцировки и речь уже идет о II ее степени. При этой гистологической форме анеуплоидия достигает 25%. В клетках паренхимы аденокарциномы как I, так и II степени дифференцировки всегда можно обнаружить признаки секреции - основного показателя сохранения функциональной адекватности клеточных элементов.
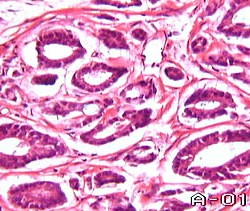 Аденокарцинома III степени представлена резко атипичными клетками, которые если и образуют подобие железистых структур, то эти структуры теряются в огромных массивах солидного компонента опухоли. Только при аденокарциноме III степени дифференцировки в опухолевых клетках можно обнаружить атипические митозы, тогда как при I и II степени они очень редки. Содержание анеуплоидных клеток в низкодифференцированной опухоли достигает 35-40%.В настоящее время в мире стандартизация оценки степени дифференцировки аденокарциномы предстательной железы осуществляется на основе системы, предложенной Глисоном (Gleason) в 1967 году.
Аденокарцинома III степени представлена резко атипичными клетками, которые если и образуют подобие железистых структур, то эти структуры теряются в огромных массивах солидного компонента опухоли. Только при аденокарциноме III степени дифференцировки в опухолевых клетках можно обнаружить атипические митозы, тогда как при I и II степени они очень редки. Содержание анеуплоидных клеток в низкодифференцированной опухоли достигает 35-40%.В настоящее время в мире стандартизация оценки степени дифференцировки аденокарциномы предстательной железы осуществляется на основе системы, предложенной Глисоном (Gleason) в 1967 году.
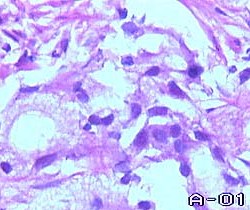 Суть этой системы заключается в разделении всех вариантов строения опухоли на 5 групп: отличающихся друг от друга степенью дифференцировки: очень хорошо, хорошо, умеренно, низко- и очень низко дифференцированная аденокарцинома. Каждой из этих групп присвоен порядковый номер от 1 до 5. При гистологическом исследовании выбираются наиболее и наименее дифференцированные участки и складывают их значения для получения коэффициента, отражающего суммарную степень дифференцировки опухоли. Бесспорно, что это в какой-то степени повышает объективность диагностики, но одновременно, ведет к некоторому "камуфлированию" истинной степени дифференцировки опухоли.
Суть этой системы заключается в разделении всех вариантов строения опухоли на 5 групп: отличающихся друг от друга степенью дифференцировки: очень хорошо, хорошо, умеренно, низко- и очень низко дифференцированная аденокарцинома. Каждой из этих групп присвоен порядковый номер от 1 до 5. При гистологическом исследовании выбираются наиболее и наименее дифференцированные участки и складывают их значения для получения коэффициента, отражающего суммарную степень дифференцировки опухоли. Бесспорно, что это в какой-то степени повышает объективность диагностики, но одновременно, ведет к некоторому "камуфлированию" истинной степени дифференцировки опухоли.
Так, сумму баллов 5 по Глисону можно получить при сложении индексов хорошо и умеренно дифференцированной аденокарциномы (2+3). Вместе с тем, ту же сумма будет при сложении баллов очень хорошо (1) и плохо (4) дифференцированного рака, что на практике вполне возможно. Такой подход может существенно затруднить представление о действительной степени дифференцировки опухоли, в то время, как при традиционно принятой в отечественной медицине системе оценки степени дифференцировки, во внимание принимается наиболее низко дифференцированная форма, поскольку именно она играет наибольшую роль в определении степени злокачественности процесса. Еще одним существенным недостатком системы Глисона является отсутствие градации степени дифференцировки опухоли для иных, чем аденокарцинома гистогенетических групп, а именно: плоскоклеточного и переходноклеточного раков.
Таким образом, учитывая международную практику, возможно определение степени дифференцировки аденокарциномы по системе Глисона, так как на нее ориентированы результаты большого числа исследований по применению различных методов лечения, разработаны рекомендации и рассчитаны прогностические номограммы (Partin и др.). Однако, для полноты восприятия, есть необходимость приводить также более привычную и, по нашему мнению, более систематизированную и унифицированную для всех гистогенетических форм РПЖ градацию опухоли по 3-м степеням дифференцировки: хорошо дифференцированную (I), умеренно дифференцированную (II) и низкодифференцированную (III), так как она представляет не какую-то особую, предназначенную только для РПЖ, систему оценки степени дифференцировки, но годится для применения также и при опухолях других локализаций, как для эпителиальных, так и для мезенхимальных опухолей, т.е. сарком.
Переходноклеточный рак - эпителиальная опухоль предстательной железы, развивающаяся из протокового эпителия, либо из метаплазировавших в преходный эпителий ацинарных эпителиоцитов. Опухоль представляет из себя ворсины, состоящие из тонких соединительнотканных прослоек, содержащих кровеносные сосуды и покрытых атипичными клетками переходного эпителия (I степень дифференцировки). При уменьшении степени дифференцировки, клетки паренхимы опухоли становятся более и более атипичными, появляются картины атипических митозов и поля солидного строения (II степень дифференцировки). Опухоль состоящая из резко атипичных клеток, содержащая большое количество митозов и имеющая солидное строение - может трактоваться как переходноклеточный рак III степени дифференцировки. Однако, в структуре переходноклеточного рака, не только II но и III степени, практически всегда можно отметить выраженную тенденцию к стратификации эпителиоцитов, даже если они представлены крайне атипичными вариантами.
Плоскоклеточный рак всегда является метапластической опухолью по отношению к злокачественным новообразования предстательной железы. Источником его развития могут быть метаплазированные эпителиоциты ацинарных или протоковых отделов предстательной железы. Прослеживается абсолютная аналогия с аденокарциномой и переходноклеточным раком по определению степени дифференцировки для данной гистогенетической группы. Нарастание степени морфологической анатоплазии (снижение степени дифференцировки), сочетающееся с потерей клетками паренхимы опухоли своих основных морфофункциональных характеристик и увеличением значимости солидного компонента, является основанием для подразделения плоскоклеточного рака на степени дифференцировки.
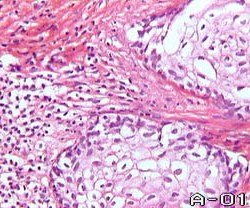 Плоскоклеточный рак I степени дифференцировки - опухоль, в которой среди атипичных эпителиоцитов многослойного плоского эпителия, обнаруживаются образования в виде так называемых "раковых жемчужин". Они представляют из себя ничто иное как, глыбки кератогиалина (процесс локальной гиперкератинизации) , окруженные атипичными эпителиоцитами. Помимо этого, сохраняющие тенденцию к стратификации клетки паренхимы рака, в подавляющем большинстве, содержат в цитоплазме кератогиалин.
Плоскоклеточный рак I степени дифференцировки - опухоль, в которой среди атипичных эпителиоцитов многослойного плоского эпителия, обнаруживаются образования в виде так называемых "раковых жемчужин". Они представляют из себя ничто иное как, глыбки кератогиалина (процесс локальной гиперкератинизации) , окруженные атипичными эпителиоцитами. Помимо этого, сохраняющие тенденцию к стратификации клетки паренхимы рака, в подавляющем большинстве, содержат в цитоплазме кератогиалин.
Способность к синтезу кератогиалина сохраняется лишь в виде внутриклеточной его конденсации. Встречаются участки солидного строения опухоли.
Плоскоклеточный рак III степени дифференцировки представлен резко атипичными клетками, образующим солидные структуры, в которых лишь на отдельных участках прослеживается тенденция к стратификации. Лишь отдельные эпителиоциты сохраняют способность к внутриклеточному синтезу кератогиалина.
 Своеобразным апофеозом злокачественности является недифференцированный рак. Эта гистологическая форма настолько атипична, что возникает необходимость дифференцировать ее с саркомами. Удивительное разнообразие клеточных форм и гистологических структур позволяет среди недифференцированного рака выделять такие подформы, как скиррозный рак (скирр). Эта опухоль представлена пластами соединительной ткани, в которой замурованы единичные эпителиоциты с яркими проявлениями клеточного атипизма. Также в соединительнотканных пластах можно обнаружить структуры, напоминающие мелкие ацинусы, либо сосочки переходного эпителия, а порой и небольшие пласты атипичного многослойного плоского эпителия.
Своеобразным апофеозом злокачественности является недифференцированный рак. Эта гистологическая форма настолько атипична, что возникает необходимость дифференцировать ее с саркомами. Удивительное разнообразие клеточных форм и гистологических структур позволяет среди недифференцированного рака выделять такие подформы, как скиррозный рак (скирр). Эта опухоль представлена пластами соединительной ткани, в которой замурованы единичные эпителиоциты с яркими проявлениями клеточного атипизма. Также в соединительнотканных пластах можно обнаружить структуры, напоминающие мелкие ацинусы, либо сосочки переходного эпителия, а порой и небольшие пласты атипичного многослойного плоского эпителия.
Однако клеточные элементы, составляющие эти скудные островки паренхимы, настолько атипичны, что сомнений в низкой степени их дифференцировки, как правило, не возникает.
Недифференцированный рак также может быть представлен миксоидноподобными структурами, когда среди моря слизи встречаются единичные мелкие, резко атипичные клетки. Но наиболее частый гистологический вид опухоли, составляют солидные разрастания резко атипичных клеток. Нередко среди них доминируют гигантские полигональные клетки с огромным гиперхромным ядром. В этих случаях речь идет о крупноклеточном раке. Однако, опухоль может быть представлена и мелкими мономорфными атипичными клетками. В этих случаях опухоль носит название мелкоклеточного рака. Если выделить доминирующую форму клеточных элементов не представляется возможным, а клеточные формы представляют самую причудливую гамму изменений, то опухоль диагностируется как полиморфноклеточный или саркомоподобный рак.
Гистологическая классификация опухолей предстательной железы (ВОЗ, №22, 1980)
- I. Эпителиальные опухоли:
- A - Доброкачественные;
- Б - Злокачественные;
- 1. Аденокарцинома
- a) мелкоацинарная;
- б) крупноацинарная;
- в) криброзная;
- г) солидно-трабекулярная;
- д) другие
- 2. Переходноклеточный рак;
- 3. Плоскоклеточный рак;
- 4. Недифференцированный рак;
- 1. Аденокарцинома
- II. Неэпителиальные опухоли:
- А - Доброкачественные;
- Б - Злокачественные:
- 1. Рабдомиосаркома;
- 2. Лейомиосаркома;
- 3. Другие.
